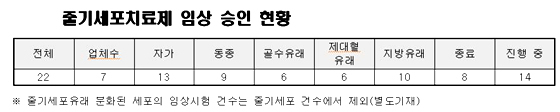
[서울=NSP통신] 강은태 기자 = 식품의약품안전청(청장 노연홍)은 국내 바이오의약품 시장진입 활성화를 위해 세포치료제 심사기준을 합리적으로 정비한 생물학적재제 등의 품목허가·심사 규정일부 개정고시안을 22일자로 행정예고 했다고 밝혔다.
이번 개정안 주요 내용은 ▲ 자가유래 세포치료제 연구자임상시험 자료의 안전성 확보된 경우 초기안전성 임상시험 자료로 인정 ▲자가유래 세포치료제의 경우 조직타이핑자료 면제 ▲개량 생물의약품(바이오베터)의 용어 정의 및 명확한 자료제출 요건 마련 ▲ 동등생물의약품(바이오시밀러) 단회투여독성시험은 반복독성투여독성시험으로 간주 등이다.
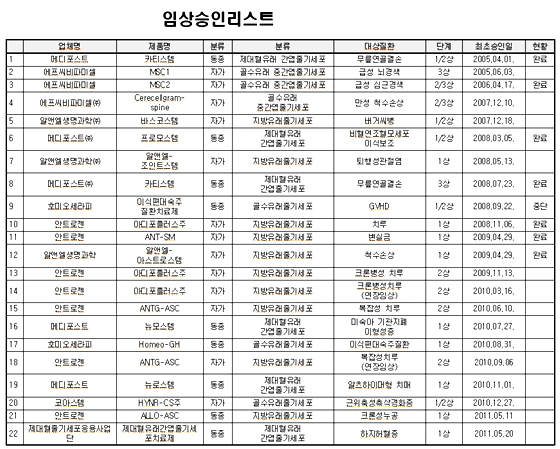
따라서 연구자임상의 상업화 진입이 가능하도록 자가유래 세포치료제 연구자임상시험의 자료가 안전성이 확보된 경우에는 초기안전성 임상시험 자료로 인정할 수 있도록 한다.
또한 조직타이핑자료는 기증자와 받는 사람의 조직이 적합한지 확인하기 위한 자료 세포치료제의 제조방법에 관한 자료로 제출 받아왔다.
하지만 자가유래 세포치료제는 원래 환자의 몸속에 있던 세포를 채취해 분리 배양한 후 다시 그 환자에게만 사용해 안전성과 유효성이 인정되기 때문에 모든 세포치료제를 동일한 심사절차 및 기준을 그대로 적용할 필요가 없어 자가유래 세포치료제의 경우 조직타이핑자료를 면제했다.

특히 이번 행정예고에는 바이오의약품 관련 업계의 R&D 투자 활성화를 위해 개량 생물의약품(바이오베터)의 용어 정의 및 명확한 자료제출 요건도 마련됐다.
뿐만 아니라 동등생물의약품(바이오시밀러) 단회투여독성시험은 반복독성투여독성시험으로 간주해 불필요한 경우 면제하로독 했다
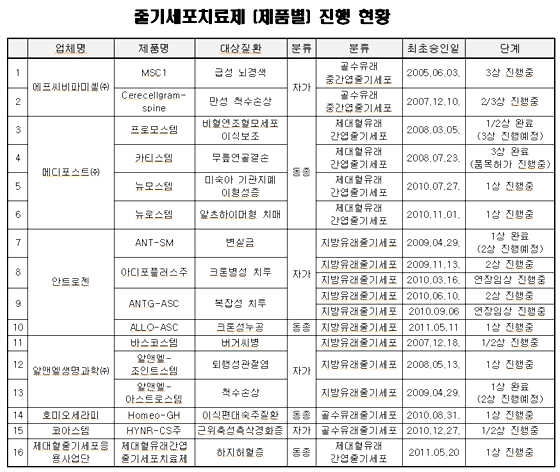
한편, 식약청은 이번 개정안을 통해 세포치료제 심사기준이 과학적이고 합리적인 수준에서 개정될 것으로 기대하며 바이오의약품의 신속한 시장진입 및 세계시장 선도를 위해 청 내 바이오의약품 관련 전담 조직을 신설 및 개편하는 작업 중에 있으며 금년 내 마무리될 예정이다고 밝혔다.
강은태 NSP통신 기자, keepwatch@nspna.com
<저작권자ⓒ 국내유일의 경제중심 종합뉴스통신사 NSP통신. 무단전재-재배포 금지.>
![[NSPAD]삼성전자](https://file.nspna.com/ad/T01_samsung_5043.gif)
![[NSP7컷]인터넷은행의 혁신적인 배신 [NSP7컷]인터넷은행의 혁신적인 배신](https://file.nspna.com/news/2023/05/30/photo_20230530123951_639759_0.jpg)
![[NSP PHOTO]신한투자증권, 조각투자 발행·유통 협력 체결…디지털 자산 생태계 구축 본격화](https://file.nspna.com/news/2026/02/19/20260219105935_803283_0.jpg)
![[NSP PHOTO]대신증권, 대신밸런스 멀티인컴랩 출시](https://file.nspna.com/news/2026/02/19/20260219101455_803271_0.jpg)
![[NSP PHOTO]키움 코리아밸류업 ETF 순자산 1000억원 돌파](https://file.nspna.com/news/2026/02/19/20260219095102_803265_0.png)
![[NSP PHOTO][들어보니]코스닥 대규모 퇴출 예고…시장 건전성 강화 vs 고의 상폐 악용 우려](https://file.nspna.com/news/2026/02/12/20260212160718_802826_0.png)
![[NSP PHOTO][들어보니]KT 6G 경쟁력, 속도에 AI 더해진다…표준 선점 경쟁 본격화](https://file.nspna.com/news/2026/02/11/20260211171637_802579_0.jpg)
![[NSP PHOTO][들어보니]효성重 전력기기 수주 판도 바뀐다…기술+보안 갖춰야 살아남는다](https://file.nspna.com/news/2026/02/06/20260206164714_801733_0.jpg)
![종근당[N06] [NSPAD]종근당](https://file.nspna.com/ad/N06_jonggdang_5089.jpg)
![하나금융그룹[N06] [NSPAD]하나금융그룹](https://file.nspna.com/ad/N06_hanagroup_5083.jpg)
![[NSP PHOTO][금융업계기상도]IBK기업은행 비온뒤갬·NH농협은행 구름조금](https://file.nspna.com/news/2026/02/13/20260213165914_803173_0.jpg)
![[NSP PHOTO][그룹주 기상도]삼성·HD현대 쾌청…경영권·주주 갈등 겪는 LG·태광 흐림](https://file.nspna.com/news/2026/02/13/20260213165904_803172_0.png)
![[NSP PHOTO][증권업계기상도]신한투자증권 맑음, 20·30세대 겨냥한 발행어음 특판 출시·대신증권 맑음, 자사주 1535만주 소각](https://file.nspna.com/news/2026/02/13/20260213163357_803158_0.png)
![[NSP PHOTO]세뱃돈 넣을 파킹통장, 금리 가장 높은 곳은…저축은행 최고 연 7%](https://file.nspna.com/news/2026/02/10/photo_20260211140527_802260_0.jpg)
![[NSP PHOTO]증권사 퇴직연금 수익률, DB·DC는 KB·현대차…IRP는 신한 선두](https://file.nspna.com/news/2026/02/15/photo_20260215223448_803239_0.png)
![[NSP PHOTO]주식광풍에 폭삭 줄어든 은행수신…대출금리 내릴 요인 없다](https://file.nspna.com/news/2026/02/11/photo_20260211152632_802510_0.jpg)
![[NSP PHOTO]박세진 세일즈포스 코리아 대표 신약개발부터 시장 진출까지 데이터 하나로…제약·헬스케어 등 규제산업 진출 가속화 나서](https://file.nspna.com/news/2026/02/13/photo_20260213154214_802995_0.jpg)
![[NSP PHOTO]남자 간호사 합격자 10년 새 4배 증가…누적 4만명 돌파](https://file.nspna.com/news/2026/02/13/photo_20260213144434_803116_0.jpg)
![[NSP PHOTO]포스코차세대 함정, 소재가 생존성 결정…스펙 업으로 표준 주도](https://file.nspna.com/news/2026/02/12/photo_20260212172714_802860_0.jpg)
![[NSP PHOTO]신한투자증권, 조각투자 발행·유통 협력 체결…디지털 자산 생태계 구축 본격화](https://file.nspna.com/news/2026/02/19/photo_20260219105935_803283_0.jpg)
![[NSP PHOTO]두산로지스틱스솔루션, 아성다이소 양주허브센터 수주…1620억원 규모 옴니채널 물류 거점 구축](https://file.nspna.com/news/2026/02/19/photo_20260219103649_803278_0.jpg)
![[NSP PHOTO] 헌트릭스, 7주차 글로벌케이팝차트 1위…33주 연속 정상](https://file.nspna.com/news/2026/02/19/photo_20260219113517_803292_0.jpg)
![[NSP PHOTO]우리 동시의 현재와 미래를 잇는 나침반… 올해의 좋은 동시 2025](https://file.nspna.com/news/2026/02/12/photo_20260212094624_802664_0.jpg)
![[NSP PHOTO][타보니]KGM 액티언 하이브리드, 성능·가성비 좋은 도심형 SUV](https://file.nspna.com/news/2025/12/17/20251217164713_793348_0.jpg)
![[NSP PHOTO][타보니]KGM 무쏘 EV, 세단 같은 정숙성·효율 좋은 전비에 잘 팔리는 픽업트럭](https://file.nspna.com/news/2025/12/04/20251204123011_790796_0.jpg)
![[NSP PHOTO][타보니]캐딜락 전기차 에스컬레이드IQ, 슈퍼크루즈 탑재 4.2톤 불구 연비 준수](https://file.nspna.com/news/2025/12/02/20251202154914_790331_0.jpg)